来源: CACLP体外诊断资讯2022年03月29日 17:22
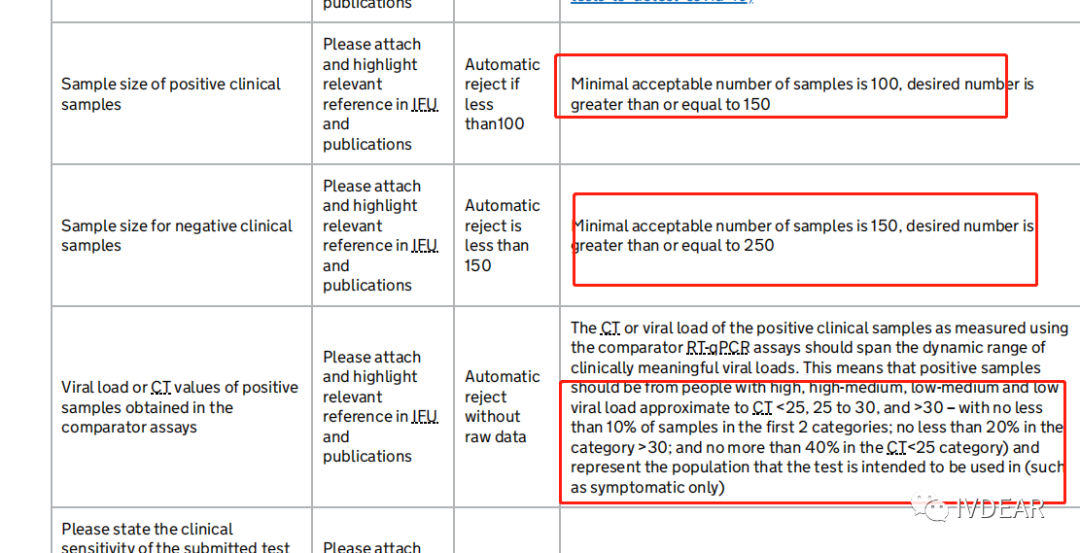
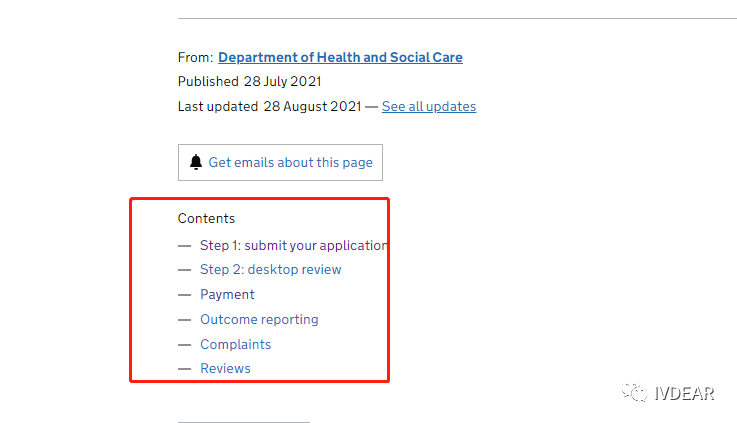
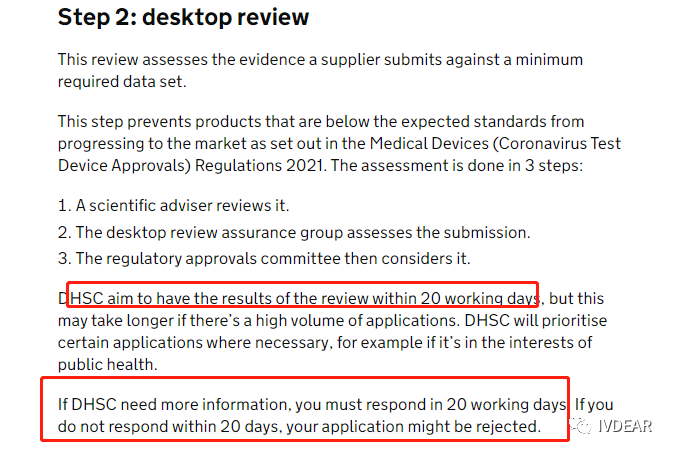
新冠抗原检测试剂盒自测版英国CTDA申请解读 英国宣布从2022年4月1日起,结束对全民免费的新冠核酸检测。这无疑给新冠抗原自测试剂盒在英国市场再次带来了大量的使用需求。 英国政府网在2022年3月21日公布了3份新冠抗原检测试剂采购订单,分别向东方生物,艾康生物和基蛋生物采购5.95亿英镑(约50亿人民币)、2.378亿英镑(约20亿人民币)和0.851亿英镑(约7亿人民币)的自测产品。 从这次三家IVD企业取得英国77亿的大订单来看,让很多新冠抗原试剂盒厂家羡慕不已,后续很大可能会吸引大量企业进入英国抗原检测试剂市场。不过想要进入英国市场,企业的新冠检测试剂就必须通过英国注册后才能在英国市场自由销售,否则将可能面临制裁。那么,抗原自测产品如何才能合法进入英国市场?我们对此特地进行了一番解读,希望对大家能有所帮助。 自2021 年 7 月 28 日,英国政府就发布了通知,要求对拟在英国市场销售的 COVID-19抗原和分子检测体外诊断设备进行验证,因此,依据药品和医疗器械法案2021版发布了CTDA (Coronavirus Test Device Approvals) (Amendment) Regulations 2021。CTDA将意味着所有 COVID-19 测试产品必须接受桌面审查,该要求适用于整个英国,这将确保在英国上市的COVID-19 检测测试产品符合最低性能标准。 从2021 年 11 月 1 日起,未经 UKHSA 团队根据最低性能标准完成桌面审查验证,不得在英国市场投放任何 COVID-19抗原和分子检测体外诊断设备,任何人如将未经验证的产品投放市场都将面临制裁。 由此可以看出,英国的药品和医疗器械法案在逐步加强监管,企业想要进入英国市场也会变得严格起来,所以还未通过英国CTDA的企业必须加快注册的进度了。 从目前来看,想要进入英国市场,企业需按照申请条件和要求填写申请、提交资料,审核通过后即可完成英国CTDA申请,具体申请要求及流程如下: 1.必须持有CE IVD(2023年6月30日或日前有效),UKCA or MHRA。如不符合此要求,申请将被自动拒绝。 2. 临床性能验证报告(PCR 参考试剂灵敏度97%(95% CI)以上,阳性样本至少100例,建议最好150例,其中CT <25 占比10%~40%;CT 25 to 30占比至少10%;and CT >30占比至少20%) 2.1提交申请前需先创建账号和登陆密码 2.2根据基本审查要求文件准备文件和提交申请,基本审查文件包含但不仅限于: 2.3提交申请安排付款(总价14000英镑,优惠价6200英镑,优惠价仅针对员工不足250人的企业) 2.4desktop review(桌面审查) 2.5Outcome reporting(DHSC(Department of Health and Social Care)公布结果) 2.6Complaints(结果投诉) 2.7Reviews(投诉审核) 3.1Manufacturer and test information包含不限于 3.2Regulatory status (注册情况及证书) 3.3Intended use case(预期用途情况) 需在说明书中明确,并主要审查预期用途包含使用人群(有无症状)、取样样本类型和要求、使用场所、使用者(专业or非专业)、结果读取时间内容) 3.4Product performance 2.1)例数要求:建议阳性150例, 阴性250例,最低要求阳性100例, 阴性150例,仅针对一个样本类型,如宣称多个样本类型,需对应增加 2.2)参考试剂:PCR对比参考,需满足灵敏度不低于97%,特异性不低于99%(95% CI); 2.3)CT 值分布:CT<25 10%~40%;CT 25 to 30至少10%;and CT>30至少20%;结合经验及各企业情况,建议在满足要求的情况下对应的例数比例为4:4:2。 2.4)灵敏度和特异性要求:灵敏度>60, 特异性>93% (95% CI) 3.5其他要求: 4.1临床性能验证:阳性样本例数需满足各CT值分布比例 4.2PCR参考试剂性能要求 4.3性能验证中如采用灭活病毒需提供灭活相关文件 通常情况下,DHSC会在资料提交后20个工作日内发布审核结果,但申请数量较多时会根据情况有所延迟。如需提交发补资料,申请人必须在收到发补意见20个工作日内提交,如未按照要求准时提交,申请将被拒绝。 综上,我司已解读CTDA申请条件、相关流程,要求及申请难点及周期,建议各企业在申请CTDA时,可同时申请3A性能验证,进入政府采购名单。尽管现在英国官方暂未对CTDA性能验证进行立法,但不排除后续DHSC会提出性能验证的要求。 IVDEAR可为企业提供英国CTDA注册咨询服务及临床性能评估、英代业务,如您有相关问题需交流或业务对接,可与IVDEAR业务负责人取得联络。

本文著作权属原创者所有,不代表本站立场。我们转载此文出于传播更多资讯之目的,如涉著作权事宜请联系删除。